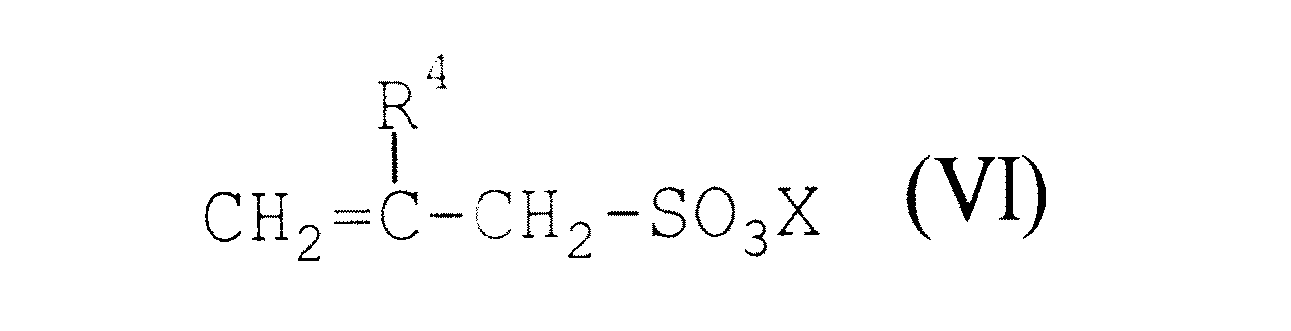JP3674841B2 - Allylamine-allylsulfonic acid copolymer, its production method and use - Google Patents
Allylamine-allylsulfonic acid copolymer, its production method and use Download PDFInfo
- Publication number
- JP3674841B2 JP3674841B2 JP2001098480A JP2001098480A JP3674841B2 JP 3674841 B2 JP3674841 B2 JP 3674841B2 JP 2001098480 A JP2001098480 A JP 2001098480A JP 2001098480 A JP2001098480 A JP 2001098480A JP 3674841 B2 JP3674841 B2 JP 3674841B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- general formula
- allylamine
- hydrogen atom
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Landscapes
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Paper (AREA)
- Polymerisation Methods In General (AREA)
- Polymerization Catalysts (AREA)
Description
【0001】
【発明の属する技術分野】
本発明は、アリルアミン−アリルスルホン酸系共重合体、その製造方法および用途に関する。さらに詳しくは、本発明は、紙処理剤、特に耐光性に優れる紙処理剤などとして有用なアリルアミン−アリルスルホン酸系共重合体、このものを簡単な操作により高収率で製造する工業的に有利な製造方法、および上記アリルアミン−アリルスルホン酸系共重合体を含む耐光性に優れる紙処理剤に関するものである。
【0002】
【従来の技術】
一般の水溶性高分子化合物は、その分子量、イオン性等によって、ろ水性向上剤、歩留り向上剤、サイジング剤、紙力増強剤、紙塗工剤、紙加工剤をはじめとする製紙用薬剤として製紙分野で大量に用いられている。
【0003】
このような製紙用薬剤の中で、アリルアミン類を原料として用いたものとして、例えばモノアリルアミン化合物やジアリルアミン化合物と、フマル酸、マレイン酸、シトラコン酸、イタコン酸などの不飽和ジカルボン酸とを共重合させてなる両性高分子化合物が知られている(特開平6−212597号公報)。
【0004】
一方、近年、コンピュータ利用技術の普及により、コンピュータにより作成した資料をプリンターなどを用いてプリントアウトすることが頻繁に行われるようになってきた。その際使用されるプリンターとしてはドットインパクトプリンター、レーザープリンター、サーマルプリンター、インクジェットプリンターなどが挙げられるが、プリントアウト時の機械的騒音がほとんどなく、かつプリントアウトに伴うランニングコストの低さから、インクジェットプリンターが多く用いられている。このインクジェットプリンターを使用する際に用いられる用紙としては、通常、普通紙やコート紙が多く用いられている。
【0005】
このようなインクジェットプリンターに使用される用紙は、一般に紙処理剤によって表面処理されており、この紙処理剤の1つとして、ポリアリルアミンが用いられている。上記紙処理剤に対しては、耐光性に優れるものが要求されるが、ポリアリルアミンを用いた紙処理剤は、必ずしも耐光性が十分でないという問題があった。
【0006】
ところで、アリルアミン類を用いた重合体としては、モノアリルアミン系化合物およびジアリルアミン系化合物の中から選ばれる1種または2種以上を重合させてなる単独重合体や共重合体、あるいはモノアリルアミン系化合物やジアリルアミン系化合物と、不飽和カルボン酸やその他単量体との共重合体が知られている。しかしながら、モノアリルアミン系化合物やジアリルアミン系化合物とアリルスルホン酸化合物との共重合体は、これまで知られていない。
【0007】
【発明が解決しようとする課題】
本発明は、このような事情のもとで、紙処理剤、特に耐光性に優れる紙処理剤などとして有用なアリルアミン系重合体、このものを簡単な操作により高収率で製造する工業的に有利な製造方法、および上記アリルアミン系重合体を含む耐光性に優れる紙処理剤を提供することを目的とするものである。
【0008】
【課題を解決するための手段】
本発明者らは、前記目的を達成するために鋭意研究を重ねた結果、モノアリルアミン化合物由来の構成単位やジアリルアミン化合物由来の構成単位と、アリルスルホン酸化合物由来の構成単位を有するアリルアミン−アリルスルホン酸系共重合体が、耐光性に優れ、インクジェットプリンター用紙処理剤として有用であること、このものは、極性溶媒中で特定のラジカル開始剤を用い、モノアリルアミン化合物やジアリルアミン化合物とアリルスルホン酸化合物とを共重合させることにより、高収率で得られることを見出し、この知見に基づいて本発明を完成するに至った。
【0009】
すなわち、本発明は、
(1)(A)一般式(I)、一般式(II−a)および一般式(II−b)
【0010】
【化5】
【0011】
(式中、R1、R2およびR3は、それぞれ水素原子、水酸基を有していてもよい炭素数1〜10のアルキル基または炭素数7〜10のアラルキル基を示し、R1およびR2はたがいに同一であっても異なっていてもよい。)
で表される構成単位およびその付加塩の中から選ばれる少なくとも1種と、(B)一般式(III)
【0012】
【化6】
【0013】
(式中、R4は水素原子又はメチル基、Xは水素原子、アルカリ金属またはアンモニウム基を示す。)
で表される構成単位を有し、共重合性架橋剤に由来する単位を含まないことを特徴とするアリルアミン−アリルスルホン酸系共重合体、
【0014】
(2)(A)単位と(B)単位との含有割合が、モル比で1:10ないし10:1である第(1)項に記載のアリルアミン−アリルスルホン酸系共重合体、
(3)極性溶媒中において、分子中にアゾ基を有する水溶性ラジカル開始剤または過硫酸塩系ラジカル開始剤の存在下、(a)一般式(IV)および一般式(V)
【0015】
【化7】
【0016】
(式中、R1、R2およびR3は前記と同じである。)
で表されるアリルアミン類の付加塩から選ばれる少なくとも1種と、(b)一般式(VI)
【0017】
【化8】
【0018】
(式中、R4は前記と同じである。)
で表されるアリルスルホン酸化合物を共重合させることを特徴とする第(1)項または第(2)項に記載のアリルアミン−アリルスルホン酸系共重合体の製造方法、
【0019】
(4)極性溶媒が水、無機酸、無機酸の水溶液、無機酸の金属塩の水溶液、有機酸、有機酸の水溶液または極性有機溶媒である第(3)項に記載の方法。
(5)第(1)項または第(2)項に記載のアリルアミン−アリルスルホン酸系共重合体を含むことを特徴とするインクジェットプリンター用紙処理剤、
(6)耐光性を有する第(5)項に記載のインクジェットプリンター用紙処理剤、
を提供するものである。
【0020】
【発明の実施の形態】
本発明のアリルアミン−アリルスルホン酸系共重合体は、構成単位として、(A)一般式(I)、一般式(II−a)および一般式(II−b)
【0021】
【化9】
【0022】
で表される単位およびその付加塩の中から選ばれる少なくとも1種と、(B)一般式(III)
【0023】
【化10】
【0024】
で表される単位を有するものである。この共重合体はランダム、ブロックのいずれであってもよい。
【0025】
前記(A)構成単位において、一般式(I)におけるR1およびR2、並びに一般式(II−a)、(II−b)におけるR3は、それぞれ水素原子、水酸基を有していてもよい炭素数1〜10のアルキル基または炭素数7〜10のアラルキル基を示す。ここで、水酸基を有していてもよい炭素数1〜10のアルキル基は直鎖状、分岐状、環状のいずれであってもよく、このようなものとしては、水酸基を有していてもよい炭素数1〜4のアルキル基、具体的にはメチル基、エチル基、n−プロピル基、イソプロピル基、各種ブチル基、2−ヒドロキシエチル基、2−ヒドロキシプロピル基、3−ヒドロキシプロピル基などを、さらにはシクロヘキシル基を好ましく挙げることができる。また、炭素数7〜10のアラルキル基の例としては、ベンジル基、フェネチル基などを好ましく挙げることができる。
【0026】
前記一般式(I)におけるR1とR2は、たがいに同一であってもよいし、異なっていてもよい。また、一般式(I)、(II−a)、(II−b)で表される構成単位の付加塩としては、例えば塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、亜硫酸塩、リン酸塩、アミド硫酸塩、メタンスルホン酸塩などが挙げられる。
【0027】
一方、前記(B)構成単位において、一般式(III)におけるR4は水素原子またはメチル基、Xは水素原子、ナトリウムやカリウムなどのアルカリ金属またはアンモニウム基を示す。
本発明のアリルアミン−アリルスルホン酸系共重合体における前記(A)構成単位と(B)構成単位の含有割合は、モル比で1:10〜10:1の範囲が好ましく、より好ましくは1:5〜5:1の範囲であり、特に好ましくは1:3〜3:1の範囲である。
【0028】
また、分子量は、ゲルパーミエーションクロマトグラフィー(GPC)法によるポリエチレングリコール換算の重量平均分子量で、通常500〜10,000、好ましくは800〜5,000の範囲である。
このアリルアミン−アリルスルホン酸系共重合体は、以下に示す本発明の方法により、効率よく、高収率で製造することができる。
【0029】
本発明の方法においては、極性溶媒中において、分子中にアゾ基を有する水溶性ラジカル開始剤または過硫酸塩系ラジカル開始剤の存在下、(a)一般式(IV)および一般式(V)
【0030】
【化11】
【0031】
(式中、R1、R2およびR3は前記と同じである。)
で表されるアリルアミン類の付加塩から選ばれる少なくとも1種と、(b)一般式(VI)
【0032】
【化12】
【0033】
(式中、R4およびXは前記と同じである。)
で表されるアリルスルホン酸化合物を共重合させる。
【0034】
上記極性溶媒としては、例えば水、無機酸(塩酸、硫酸、リン酸、ポリリン酸など)またはその水溶液、無機酸の金属塩(塩化亜鉛、塩化カルシウム、塩化マグネシウムなど)の水溶液、有機酸(ギ酸、酢酸、プロピオン酸、乳酸など)またはその水溶液、あるいは極性有機溶媒(アルコール、ジメチルスルホキシド、ジメチルホルムアミドなど)等を挙げることができるが、これらの混合物でもよい。また、これらの中で水系溶媒が好ましい。
【0035】
また、ラジカル開始剤(ラジカル重合開始剤)の中で、分子中にアゾ基を有する水溶性ラジカル開始剤(以下、水溶性アゾ系開始剤と称すことがある。)としては、分子中にアゾ基とカチオン性窒素をもつ基とを有するラジカル重合開始剤が好ましく、このようなラジカル重合開始剤としては、従来公知の化合物の中から、任意に選択して用いることができ、中でも一般式(VII)
R5−N=N−R6 …(VII)
[式中のR5とR6の少なくとも一方がアミノヒドロカルビル基、アミジニルヒドロカルビル基およびシアノアミノヒドロカルビル基の中から選ばれるカチオン化しうる窒素原子を含む基で、残りはヒドロカルビル基またはシアノヒドロカルビル基であり、R5とR6は、これらが一緒になって一般式(VIII)
【0036】
【化13】
【0037】
(Rはアルキレン基、Yはカチオン化しうる窒素原子を含む基であり、共有結合(a)および(b)はそれぞれアゾ基の窒素原子と結合してアゾ基を含む環を形成している。)
で示される単一のアルキレン基を形成してもよい。]
で表されるアゾ化合物の無機酸塩または有機酸塩が、合成の容易さなどの点で実用に供される。
【0038】
この一般式(VII)におけるR5およびR6の中で、アミノヒドロカルビル基としては、例えばアミノアルキル基、アミノアリール基、アミノアルカリール基、アミノアラルキル基などが挙げられ、アミジニルヒドロカルビル基としては、例えばアミジニルアルキル基、アミジニルアリール基、アミジニルアルカリール基、アミジニルアラルキル基などが挙げられ、シアノアミノヒドロカルビル基としては、例えばシアノアミノアルキル基、シアノアミノアリール基、シアノアミノアルカリール基、シアノアミノアラルキル基などが挙げられる。また、ヒドロカルビル基としては、例えばアルキル基、アリール基、アルカリール基、アラルキル基などが挙げられ、シアノヒドロカルビル基としては、例えばシアノアルキル基、シアノアリール基、シアノアルカリール基、シアノアラルキル基などが挙げられる。
一方、一般式(VIII)のRで示されるアルキレン基としては、例えば直鎖状アルキレン基、アルキルアルキレン基、アリールアルキレン基などが挙げられる。
【0039】
上記一般式(VII)で表されるラジカル重合開始剤の例としては、2,2′−ジアミジニル−2,2′−アゾプロパン・塩酸塩[2,2′−アゾビス(2−アミジノプロパン)塩酸塩]、2,2′−ジアミジニル−2,2′−アゾブタン・塩酸塩、2,2′−ジアミジニル−2,2′−アゾペンタン・塩酸塩、2,2′−ビス(N−フェニルアミジニル)−2,2′−アゾプロパン・塩酸塩、2,2′−ビス(N−フェニルアミジニル)−2,2′−アゾブタン・塩酸塩、2,2′−ビス(N,N−ジメチルアミジニル)−2,2′−アゾプロパン・塩酸塩、2,2′−ビス(N,N−ジメチルアミジニル)−2,2′−アゾブタン・塩酸塩、2,2′−ビス(N,N−ジエチルアミジニル)−2,2′−アゾプロパン・塩酸塩、2,2′−ビス(N,N−ジエチルアミジニル)−2,2′−アゾブタン・塩酸塩、2,2′−ビス(N−ジn−ブチルアミジニル)−2,2′−アゾプロパン・塩酸塩、2,2′−ビス(N−ジn−ブチルアミジニル)−2,2′−アゾブタン・塩酸塩、3,3′−ビス(N,N−ジn−ブチルアミジニル)−3,3′−アゾペンタン・塩酸塩、アゾ−ビス−N,N′−ジメチレンイソブチルアミジン・塩酸塩;2,2′−アゾ−ビス(2−メチル−4−ジエチルアミノ)−ブチロニトリル・塩酸塩、2,2′−アゾ−ビス(2−メチル−4−ジメチルアミノ)−ブチロニトリル・塩酸塩、2,2′−アゾ−ビス(2−メチル−4−ジエチルアミノ)−ブチロニトリル・塩酸塩、2,2′−アゾ−ビス(2−メチル−4−ジエチルアミノ)−ブチロニトリルまたは2,2′−アゾ−ビス(2−メチル−4−ジメチルアミノ)−ブチロニトリルを、ジメチル硫酸またはp−トルエンスルホン酸メチルなどで四級化して得た第4アンモニウム塩型アゾニトリル;3,5−ジアミジニル−1,2−ジアゾ−1−シクロペンテン・塩酸塩、3−メチル−3,4−ジアミジニル−1,2−ジアゾ−1−シクロペンテン・塩酸塩、3−エチル−3,5−ジアミジニル−1,2−ジアゾ−1−シクロペンテン・塩酸塩、3,5−ジメチル−3,5−ジアミジニル−1,2−ジアゾ−1−シクロペンテン・塩酸塩、3,6−ジアミジニル−1,2−ジアゾ−1−シクロヘキセン・塩酸塩、3−フェニル−3,5−ジアミジニル−1,2−ジアゾ−1−シクロペンテン・塩酸塩、3,5−ジフェニル−3,5−ジアミジニル−1,2−ジアゾ−1−シクロペンテン・塩酸塩などが挙げられる。塩酸塩の場合、二塩酸塩でもよい。
【0040】
また、水溶性アゾ系開始剤として、一般式(IX)
【0041】
【化14】
【0042】
[式中、R7〜R10は、それぞれ独立に低級アルキル基、R11およびR12は、それぞれ独立に、一般式(X)
【0043】
【化15】
【0044】
(ただし、Zは炭素数1〜12のアルキレン基)
で示されるヒドロキシアルキルアミド基またはヒドロキシアルキルエステル基を示す。]
で表される化合物も用いることができる。
【0045】
前記一般式(IX)において、R7〜R10で示される低級アルキル基としては、炭素数1〜10の飽和または不飽和のアルキル基が挙げられ、このアルキル基は直鎖状、分岐状、環状のいずれであってもよく、また、1つ以上の炭素原子がO、SまたはNによって置換されていてもよい。例えば、R7〜R10は炭素数2〜9のアルコキシアルキル基などであってもよい。
【0046】
この一般式(IX)で表される化合物の中で、R7〜R10がいずれもメチル基であって、R11およびR12として、一般式(X)におけるZがエチレン基であるものが好ましく、特に2,2′−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]が好適である。
【0047】
さらに、水溶性アゾ系開始剤として、2,2′−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]塩酸塩、2,2′−アゾビス(2−メチルブタンアミドキシム)塩酸塩なども好ましく用いることができる。
これらの水溶性アゾ系開始剤としては、1種を単独で用いてもよいし、2種以上を組み合わせて用いてもよい。
【0048】
一方、過硫酸塩系ラジカル開始剤としては、例えば過硫酸アンモニウム、過硫酸ナトリウム、過硫酸カリウムなどが挙げられ、これらは単独で用いてもよいし、2種以上を組み合わせて用いてもよい。
【0049】
本発明の方法においては、原料モノマーとして、(a)前記一般式(IV)および一般式(V)で表されるアリルアミン類の付加塩または第四級アンモニウム塩の中から選ばれる少なくとも1種、および(b)前記一般式(VI)で表されるアリルスルホン酸化合物が用いられる。
【0050】
ここで、(a)成分モノマーであるアリルアミン類の付加塩の好ましいものとしては、前記一般式(IV)で表されるモノアリルアミン化合物の付加塩として、モノアリルアミン、N−メチルアリルアミン、N−エチルアリルアミン、N−プロピルアリルアミン、N−シクロヘキシルアリルアミン、N,N−ジメチルアリルアミン、N,N−ジエチルアリルアミン、N,N−ジプロピルアリルアミン、N,N−ジシクロヘキシルアリルアミン、N,N−(メチル)シクロヘキシルアリルアミン、N,N−(エチル)シクロヘキシルアリルアミンなどの塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、亜硫酸塩、リン酸塩、アミド硫酸塩、メタンスルホン酸塩などを、前記一般式(V)で表されるジアリルアミン化合物の付加塩として、ジアリルアミン、N−メチルジアリルアミン、N−エチルジアリルアミン、N−プロピルジアリルアミン、N−ブチルジアリルアミン、N−2−ヒドロキシエチルジアリルアミン、N−2−ヒドロキシプロピルジアリルアミン、N−3−ヒドロキシプロピルジアリルアミンなどの塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、亜硫酸塩、リン酸塩、アミド硫酸塩、メタンスルホン酸塩などを、挙げることができる。これらの(a)成分モノマーは、1種を単独で用いてもよいし、2種以上を組み合わせて用いてもよい。
【0051】
一方、(b)成分モノマーである前記一般式(VI)で表されるアリルスルホン酸化合物としては、例えばアリルスルホン酸、メタリルスルホン酸、アリルスルホン酸ナトリウム、メタリルスルホン酸ナトリウム、アリルスルホン酸カリウム、メタリルスルホン酸カリウム、アリルスルホン酸アンモニウム、メタリルスルホン酸アンモニウムなどが挙げられる。これらのアリルスルホン酸化合物は、1種を単独で用いてもよいし、2種以上を組み合わせて用いてもよい。
【0052】
本発明における重合方法としては、例えば前記極性溶媒、好ましくは水系溶媒中に、所定の割合の前記(a)成分モノマーと(b)成分モノマーを、それらの合計量の濃度が通常20〜80重量%、好ましくは25〜75重量%になるように加えると共に、前述のラジカル開始剤を、モノマー全量に対し、好ましくは0.1〜15モル%、より好ましくは0.5〜12モル%の割合で加え、30〜90℃程度、好ましくは40〜80℃の温度で重合反応を行う。反応時間は、モノマーの種類やラジカル開始剤の種類、反応温度などに左右され、一概に定めることはできないが、通常24〜120時間程度で十分である。
【0053】
このようにして生成したアリルアミン−アリルスルホン酸系共重合体は、付加塩および/または第四級アンモニウム塩を形成しているので、公知の方法により、付加塩および/または第四級アンモニウム塩の形で取り出し、精製してもよいし、所望により、アルカリで処理したのち、遊離の形で取り出し、精製してもよい。さらに、このようにして精製された遊離の形の重合体に、所望の酸を付加させ、完全付加塩または部分付加塩にすることができる。
【0054】
このようにして得られたアリルアミン−アリルスルホン酸系共重合体は、両性高分子化合物であるにもかかわらず、pH1〜13の範囲で水に溶解する性質を有し、紙処理剤や染色助剤などとして有用である。特に紙処理剤として用いる場合、優れた耐光性を付与することができる。
【0055】
本発明はまた、前記アリルアミン−アリルスルホン酸系共重合体を含むインクジェットプリンター用紙処理剤をも提供する。この紙処理剤は、従来のポリアリルアミンを含む紙処理剤に比べて、耐光性に優れており、例えばインクジェットプリンターに使用される用紙などに用いられる。
【0056】
【実施例】
次に、本発明を実施例により、さらに詳細に説明するが、本発明は、これらの例によってなんら限定されるものではない。
【0057】
なお、共重合体の重合平均分子量は、下記の方法に従って測定した。
〈共重合体の重量平均分子量の測定〉
共重合体の重量平均分子量(Mw)は、日立L−6000型高速液体クロマトグラフを使用し、ゲル・パーミエーション・クロマトグラフィー(GPC法)によって測定した。溶離液流路ポンプは日立L−6000、検出器はショーデックスRI SE−61示差屈折率検出器、カラムはアサヒパックの水系ゲル濾過タイプのGS−220HQ(排除限界分子量3,000)とGS−620HQ(排除限界分子量200万)とをダブルに接続したものを用いた。サンプルは溶離液で0.5g/100mlの濃度に調整し、20μlを用いた。溶離液には、0.4mol/lの塩化ナトリウム水溶液を使用した。カラム温度は30℃で、流速は1.0ml/分で実施した。標準サンプルとして分子量106、194、440、600、1470、4100、7100、10300、12600、23000などのポリエチレングリコールを用いて較正曲線を求め、その較正曲線を基に共重合体のMwを求めた。
【0058】
実施例1
攪拌機、温度計、還流式冷却管を備えた3000mlの4つ口丸底セパラブルフラスコ中にアリルスルホン酸ナトリウム360.3g(2.5モル)を仕込み、それに濃度57.3重量%のアリルアミン塩酸塩水溶液408.3g(2.5モル)を加え、さらに蒸留水419.8gを追加して均一透明のモノマー溶液を調製した。フラスコ内温50℃、攪拌下、2,2′−アゾビス(2−アミジノプロパン)二塩酸塩(ABAP)27.1g(モノマーに対して2.0モル%)を添加し、さらに、重合反応を開始してから24時間経過した後にもABAP40.68g(3.0モル%)を添加した。重合反応は50℃で合計72時間行った。
【0059】
得られた反応溶液をメタノール中に投入することにより白色沈殿を生成させ、さらにメタノールで洗浄後、ろ別して50℃で72時間の加熱真空乾燥を行った。白色微粉末の粗製共重合体443.2g(単離収率74.59%)を得た。この粗製共重合体の重量平均分子量は1500であった。
【0060】
攪拌機、温度計、還流式冷却管を備えた1000mlの4つ口丸底セパラブルフラスコ中に、上記粗製重合体163.8g(0.72モル)を仕込み、蒸留水200gを添加して溶解させた。蒸留水200gに溶解した水酸化ナトリウム28.6gを徐々に滴下した。得られた溶液をエバポレータを用いて脱モノマーした後、透析を行った。脱塩処理された溶液を濃縮後、メタノール中に投入して再沈精製し、洗浄してろ取後、真空加熱乾燥を行った。
【0061】
得られた白色微粉末の共重合体(フリー)の赤外分光スペクトルを図1に示す。GPC測定によるクロマトグラムを図2に示す。1/10モル/リットルのNaCl水溶液中、25℃、0.5g/dlの濃度で測定した固有粘度は0.0244であった。元素分析の結果、C=36.33%、H=7.34%、N=5.92%、S=15.05%であった。これらより、アリルスルホン酸ナトリウム:アリルアミンの共重合比は1:0.75であった。
【0062】
実施例2〜12、比較例1
実施例1において、アリルアミン塩酸塩の代わりに表1に示すアリルアミン類の塩を用い、かつ表1に示すラジカル開始剤を用い、実施例1と同様に重合を行い、粗製共重合体を得た。
この粗製共重合体の重合収率および重量平均分子量を、モノマー濃度およびラジカル開始剤の使用量と共に、表1に示す。
【0063】
【表1】
【0064】
[注]
MMAA・HCl:N−メチルアリルアミン塩酸塩
DMAA・HCl:N,N−ジメチルアリルアミン塩酸塩
AA・NH2SO3H:モノアリルアミンアミド硫酸塩
DAA・HCl:ジアリルアミン塩酸塩
MDAA・HCl:N−メチルジアリルアミン塩酸塩
HOEDAA・HCl:N−ヒドロキシエチルジアリルアミン塩酸塩
DADMAC:ジアリルジメチルアンモニウムクロリド
AA・HCl:アリルアミン塩酸塩
ABAP:2,2′−アゾビス(2−アミジノプロパン)二塩酸塩
VA−044:2,2′−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]二塩酸塩
VA−086:2,2′−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]
OTazo−30:2,2′−アゾビス(2−メチルブタンアミドキシム)二塩酸塩
APS:過硫酸アンモニウム
AIBN:アゾビスイソブチロニトリル
【0065】
比較例1はラジカル開始剤として、非水溶性のアゾビスイソブチロニトリル(AIBN)を使用したため、重合反応は全く起こらなかった。
なお、図3に、実施例5で得られた共重合体のGPC測定によるクロマトグラムを示す。
【0066】
実施例13〜18
表2に示すモノマーの仕込み比、モノマー濃度およびラジカル開始剤の使用量の条件にて、実施例1と同様に重合を行い、粗製共重合体を得た。
この粗製共重合体の重合比率および固有粘度を表2に示す。なお、固有粘度は、1/10モル/リットル濃度のNaCl水溶液中、25℃、0.5g/dlの濃度で測定した値である。
【0067】
【表2】
【0068】
試験例1 耐光性試験
シリカ[(株)トクヤマ製「ファインシールX−37B」]10重量部、ポバール[(株)クラレ製「PVA−117」]3重量部、試験対象ポリマー2重量部を混合し、シリカ濃度が15重量%になるように調整して紙処理剤を作製した。
普通紙(コピー用紙)に、上記紙処理剤を、三矢化成(株)製「R.D.S.ラボラトリー・コーティング・ロッド」を用いて、乾燥厚さが10μmになるように均一に塗布し、加熱乾燥することにより、試験用紙を作製した。
【0069】
次に、この試験用紙に、市販のインクジェットプリンター「EPSON PM−770C」を用いて印刷したのち、これに、スガ試験機(株)製「キセノンフェードメーターX25F」を用い、放射照度60W/m2、BPT(ブラックパネル温度)63℃、湿度50%RH、照射時間22時間の条件で照射を行い、目視および色彩色差計「ミノルタCR−321」を用い、耐光性を下記の判定基準で評価した。結果を表3に示す。
A:退色なし
B:ほとんど退色なし
C:幾分退色あり
D:退色あり
【0070】
【表3】
【0071】
1)ブランク:紙処理剤に試験対象ポリマーを添加しないもの。
2)PAA:ポリアリルアミン、日東紡績(株)製、Mw1200
3)PEI:ポリエチレンイミン、日本触媒化学工業(株)製、Mw1800
4)PVAm:ポリビニルアミン、三菱化学(株)製、Mw60000
【0072】
表3から、本発明のアリルアミン−アリルスルホン酸系共重合体は、紙処理剤に用いた場合、良好な耐光性を付与することが分かる。特にフリーの共重合体は優れた耐光性を付与する。
【0073】
試験例2 耐水性試験
蒸留水に試験対象ポリマーを溶解し、そのポリマー溶液中に普通紙を浸漬させた後に、乾燥させることによって試験用紙を作製した。
次に、この試験用紙に、各種プリンターを用いて印刷し、自然乾燥後に一滴の蒸留水を垂らした。自然乾燥の後にそのにじみの状態を目視で評価した。
【0074】
実施例で得られた各アリルアミン−アリルスルホン酸系共重合体は、いずれもブランクに比較してポリアリルアミンと同様に耐水性の向上が見られた。
【0075】
【発明の効果】
本発明によれば、紙処理剤、特に耐光性に優れる紙処理剤などとして有用なアリルアミン−アリルスルホン酸系共重合体を簡単な操作により収率よく、工業的に有利に得ることができる。
【図面の簡単な説明】
【図1】実施例1で得られた電気透析処理SAS/AA共重合体の赤外分光スペクトル図である。
【図2】実施例1で得られた電気透析処理SAS/AA共重合体のGPC測定によるクロマトグラムである。
【図3】実施例5で得られたSAS/DAA・HCl共重合体のGPC測定によるクロマトグラムである。[0001]
BACKGROUND OF THE INVENTION
The present invention relates to an allylamine-allylsulfonic acid copolymer, a method for producing the same, and use thereof. More specifically, the present invention relates to an allylamine-allylsulfonic acid copolymer useful as a paper treatment agent, particularly a paper treatment agent excellent in light resistance, and the like. The present invention relates to an advantageous production method and a paper treatment agent having excellent light resistance, comprising the allylamine-allylsulfonic acid copolymer.
[0002]
[Prior art]
General water-soluble polymer compounds are used as paper making agents, including freeness improvers, yield improvers, sizing agents, paper strength enhancers, paper coating agents, and paper processing agents, depending on their molecular weight and ionicity. Used in large quantities in the papermaking field.
[0003]
Among these papermaking chemicals, allylamines are used as raw materials, for example, monoallylamine compounds and diallylamine compounds are copolymerized with unsaturated dicarboxylic acids such as fumaric acid, maleic acid, citraconic acid and itaconic acid. An amphoteric polymer compound is known (Japanese Patent Laid-Open No. 6-212597).
[0004]
On the other hand, in recent years, with the spread of computer utilization technology, it has become frequent to print out materials created by a computer using a printer or the like. Printers used at that time include dot impact printers, laser printers, thermal printers, inkjet printers, etc., but there is almost no mechanical noise at the time of printout, and because of low running costs associated with printout, inkjet Many printers are used. Usually, plain paper or coated paper is often used as paper used when using this ink jet printer.
[0005]
The paper used in such an ink jet printer is generally surface-treated with a paper treatment agent, and polyallylamine is used as one of the paper treatment agents. The paper processing agent is required to have excellent light resistance, but the paper processing agent using polyallylamine has a problem that the light resistance is not always sufficient.
[0006]
By the way, as a polymer using allylamines, a homopolymer or copolymer obtained by polymerizing one or more selected from monoallylamine compounds and diallylamine compounds, monoallylamine compounds, Copolymers of diallylamine compounds with unsaturated carboxylic acids and other monomers are known. However, a copolymer of a monoallylamine compound or a diallylamine compound and an allyl sulfonic acid compound has not been known so far.
[0007]
[Problems to be solved by the invention]
Under such circumstances, the present invention is a paper processing agent, particularly an allylamine polymer useful as a paper processing agent having excellent light resistance, and the like. An object of the present invention is to provide an advantageous production method and a paper treatment agent having excellent light resistance, which contains the allylamine polymer.
[0008]
[Means for Solving the Problems]
As a result of intensive studies to achieve the above object, the present inventors have found that allylamine-allylsulfone having a structural unit derived from a monoallylamine compound or a structural unit derived from a diallylamine compound and a structural unit derived from an allylsulfonic acid compound. Acid copolymer has excellent light resistanceFor inkjet printerUseful as a paper treatment agent, which can be obtained in high yield by copolymerizing a monoallylamine compound or a diallylamine compound and an allylsulfonic acid compound using a specific radical initiator in a polar solvent. Based on this finding, the present invention has been completed.
[0009]
That is, the present invention
(1) (A) General formula (I), general formula (II-a) and general formula (II-b)
[0010]
[Chemical formula 5]
[0011]
(Wherein R1, R2And RThreeRepresents a hydrogen atom, an alkyl group having 1 to 10 carbon atoms or an aralkyl group having 7 to 10 carbon atoms, which may have a hydroxyl group, and R1And R2They may be the same or different. )
The unit represented byandThat additionSaltyAt least one selected from the group consisting of (B) the general formula (III)
[0012]
[Chemical 6]
[0013]
(Wherein RFourRepresents a hydrogen atom or a methyl group, and X represents a hydrogen atom, an alkali metal or an ammonium group. )
With a structural unitAnd does not contain units derived from copolymerizable crosslinking agentsAn allylamine-allylsulfonic acid copolymer,
[0014]
(2) The allylamine-allylsulfonic acid copolymer according to item (1), wherein the content ratio of the (A) unit and the (B) unit is 1:10 to 10: 1 in molar ratio;
(3) In a polar solvent, in the presence of a water-soluble radical initiator or a persulfate radical initiator having an azo group in the molecule, (a) general formula (IV) and general formula (V)
[0015]
[Chemical 7]
[0016]
(Wherein R1, R2And RThreeIs the same as above. )
Addition of allylamines represented bySaltAt least one selected from the group (b) general formula (VI)
[0017]
[Chemical 8]
[0018]
(Wherein RFourIs the same as above. )
A method for producing an allylamine-allylsulfonic acid copolymer according to item (1) or (2), wherein an allylsulfonic acid compound represented by formula (1) is copolymerized:
[0019]
(4) The method according to item (3), wherein the polar solvent is water, an inorganic acid, an aqueous solution of an inorganic acid, an aqueous solution of a metal salt of an inorganic acid, an organic acid, an aqueous solution of an organic acid, or a polar organic solvent.
(5) An allylamine-allylsulfonic acid copolymer described in (1) or (2) is included.For inkjet printerPaper treatment agent,
(6) As described in item (5) having light resistanceFor inkjet printerPaper treatment agent,
Is to provide.
[0020]
DETAILED DESCRIPTION OF THE INVENTION
The allylamine-allylsulfonic acid copolymer of the present invention includes (A) general formula (I), general formula (II-a) and general formula (II-b) as structural units.
[0021]
[Chemical 9]
[0022]
Units represented byandThat additionSaltyAt least one selected from the group consisting of (B) the general formula (III)
[0023]
[Chemical Formula 10]
[0024]
It has a unit represented by. This copolymer may be either random or block.
[0025]
In the structural unit (A), R in the general formula (I)1And R2And R in the general formulas (II-a) and (II-b)ThreeRepresents a hydrogen atom, an alkyl group having 1 to 10 carbon atoms which may have a hydroxyl group, or an aralkyl group having 7 to 10 carbon atoms. Here, the alkyl group having 1 to 10 carbon atoms which may have a hydroxyl group may be linear, branched or cyclic, and as such, it may have a hydroxyl group. Good alkyl group having 1 to 4 carbon atoms, specifically methyl group, ethyl group, n-propyl group, isopropyl group, various butyl groups, 2-hydroxyethyl group, 2-hydroxypropyl group, 3-hydroxypropyl group, etc. Furthermore, a cyclohexyl group can be mentioned preferably. Moreover, as an example of a C7-10 aralkyl group, a benzyl group, a phenethyl group, etc. can be mentioned preferably.
[0026]
R in the general formula (I)1And R2May be the same or different. Examples of addition salts of the structural units represented by the general formulas (I), (II-a), and (II-b) include hydrochloride, hydrobromide, sulfate, nitrate, sulfite, phosphorus Acid salts, amidosulfates, methanesulfonates, etc.The
[0027]
On the other hand, in the structural unit (B), R in the general formula (III)FourRepresents a hydrogen atom or a methyl group, X represents a hydrogen atom, an alkali metal such as sodium or potassium, or an ammonium group.
The content ratio of the structural unit (A) and the structural unit (B) in the allylamine-allylsulfonic acid copolymer of the present invention is preferably in the range of 1:10 to 10: 1, more preferably 1: It is in the range of 5-5: 1, particularly preferably in the range of 1: 3-3: 1.
[0028]
Moreover, molecular weight is the weight average molecular weight of polyethyleneglycol conversion by a gel permeation chromatography (GPC) method, and is 500-10,000 normally, Preferably it is the range of 800-5,000.
This allylamine-allylsulfonic acid copolymer can be efficiently produced in high yield by the method of the present invention described below.
[0029]
In the method of the present invention, (a) general formula (IV) and general formula (V) in the presence of a water-soluble radical initiator or persulfate radical initiator having an azo group in the molecule in a polar solvent.
[0030]
Embedded image
[0031]
(Wherein R1, R2And RThreeIs the same as above. )
Addition of allylamines represented bySaltAt least one selected from the group (b) general formula (VI)
[0032]
Embedded image
[0033]
(Wherein RFourAnd X are as defined above. )
The allyl sulfonic acid compound represented by these is copolymerized.
[0034]
Examples of the polar solvent include water, inorganic acids (hydrochloric acid, sulfuric acid, phosphoric acid, polyphosphoric acid, etc.) or aqueous solutions thereof, inorganic acid metal salts (zinc chloride, calcium chloride, magnesium chloride, etc.), organic acids (formic acid). , Acetic acid, propionic acid, lactic acid, etc.) or an aqueous solution thereof, or a polar organic solvent (alcohol, dimethyl sulfoxide, dimethylformamide, etc.), and a mixture thereof may be used. Of these, aqueous solvents are preferred.
[0035]
Among radical initiators (radical polymerization initiators), water-soluble radical initiators having an azo group in the molecule (hereinafter sometimes referred to as water-soluble azo initiators) include azo groups in the molecule. A radical polymerization initiator having a group and a group having a cationic nitrogen is preferable, and such a radical polymerization initiator can be arbitrarily selected from conventionally known compounds. VII)
RFive-N = N-R6 ... (VII)
[R in the formulaFiveAnd R6At least one of them is a group containing a cationizable nitrogen atom selected from among an aminohydrocarbyl group, an amidinylhydrocarbyl group and a cyanoaminohydrocarbyl group, and the remainder is a hydrocarbyl group or a cyanohydrocarbyl group,FiveAnd R6Together they are represented by the general formula (VIII)
[0036]
Embedded image
[0037]
(R is an alkylene group, Y is a group containing a cationizable nitrogen atom, and the covalent bonds (a) and (b) are each bonded to the nitrogen atom of the azo group to form a ring containing the azo group. )
A single alkylene group represented by may be formed. ]
An inorganic acid salt or an organic acid salt of an azo compound represented by the formula is put to practical use in terms of ease of synthesis.
[0038]
R in this general formula (VII)FiveAnd R6Among them, examples of the aminohydrocarbyl group include an aminoalkyl group, an aminoaryl group, an aminoalkaryl group, and an aminoaralkyl group. Examples of the amidinylhydrocarbyl group include an amidinylalkyl group and an amidinyl group. An aryl group, an amidinyl alkaryl group, an amidinyl aralkyl group, and the like. Examples of the cyanoaminohydrocarbyl group include a cyanoaminoalkyl group, a cyanoaminoaryl group, a cyanoaminoalkaryl group, and a cyanoaminoaralkyl group. Can be mentioned. Examples of the hydrocarbyl group include an alkyl group, an aryl group, an alkaryl group, and an aralkyl group. Examples of the cyanohydrocarbyl group include a cyanoalkyl group, a cyanoaryl group, a cyanoalkaryl group, and a cyanoaralkyl group. Can be mentioned.
On the other hand, examples of the alkylene group represented by R in the general formula (VIII) include a linear alkylene group, an alkylalkylene group, and an arylalkylene group.
[0039]
Examples of the radical polymerization initiator represented by the general formula (VII) include 2,2'-diamidinyl-2,2'-azopropane hydrochloride [2,2'-azobis (2-amidinopropane)
[0040]
In addition, as a water-soluble azo initiator, the general formula (IX)
[0041]
Embedded image
[0042]
[Wherein R7~ RTenEach independently represents a lower alkyl group, R11And R12Each independently represents a general formula (X)
[0043]
Embedded image
[0044]
(However, Z is an alkylene group having 1 to 12 carbon atoms)
A hydroxyalkylamide group or a hydroxyalkylester group represented by ]
The compound represented by these can also be used.
[0045]
In the general formula (IX), R7~ RTenExamples of the lower alkyl group represented by the formula include a saturated or unsaturated alkyl group having 1 to 10 carbon atoms, and this alkyl group may be linear, branched or cyclic, The above carbon atoms may be substituted with O, S or N. For example, R7~ RTenMay be an alkoxyalkyl group having 2 to 9 carbon atoms.
[0046]
Among the compounds represented by the general formula (IX), R7~ RTenAre both methyl groups and R11And R12In the general formula (X), Z is preferably an ethylene group, and 2,2′-azobis [2-methyl-N- (2-hydroxyethyl) propionamide] is particularly preferable.
[0047]
Further, as water-soluble azo initiators, 2,2′-azobis [2- (2-imidazolin-2-yl) propane] hydrochloride, 2,2′-azobis (2-methylbutanamidoxime) hydrochloride and the like are also included. It can be preferably used.
As these water-soluble azo initiators, one kind may be used alone, or two or more kinds may be used in combination.
[0048]
On the other hand, examples of the persulfate-based radical initiator include ammonium persulfate, sodium persulfate, and potassium persulfate. These may be used alone or in combination of two or more.
[0049]
In the method of the present invention, as a raw material monomer, (a) at least one selected from addition salts or quaternary ammonium salts of allylamines represented by the general formula (IV) and the general formula (V), And (b) an allyl sulfonic acid compound represented by the general formula (VI) is used.
[0050]
Here, (a) addition of allylamines as component monomersSaltyPreferable examples of the addition salt of the monoallylamine compound represented by the general formula (IV) include monoallylamine, N-methylallylamine, N-ethylallylamine, N-propylallylamine, N-cyclohexylallylamine, N, N- Hydrochloric acid salts such as dimethylallylamine, N, N-diethylallylamine, N, N-dipropylallylamine, N, N-dicyclohexylallylamine, N, N- (methyl) cyclohexylallylamine, N, N- (ethyl) cyclohexylallylamine, odor Hydroallylates, sulfates, nitrates, sulfites, phosphates, amidosulfates, methanesulfonates and the like are diallylamine, N-methyl as addition salts of diallylamine compounds represented by the general formula (V). Diallylamine, N-ethyldiallylamine, N Hydrochlorides such as propyl diallylamine, N-butyl diallylamine, N-2-hydroxyethyl diallylamine, N-2-hydroxypropyl diallylamine, N-3-hydroxypropyl diallylamine, hydrobromide, sulfate, nitrate, sulfite, Phosphate, amidosulfate, methanesulfonate, etc.TheI can make it. These (a) component monomers may be used individually by 1 type, and may be used in combination of 2 or more type.
[0051]
On the other hand, as the allyl sulfonic acid compound represented by the general formula (VI) as the component monomer (b), for example, allyl sulfonic acid, methallyl sulfonic acid, sodium allyl sulfonate, sodium methallyl sulfonate, allyl sulfonic acid Examples include potassium, potassium methallyl sulfonate, ammonium allyl sulfonate, and ammonium methallyl sulfonate. These allyl sulfonic acid compounds may be used individually by 1 type, and may be used in combination of 2 or more type.
[0052]
As a polymerization method in the present invention, for example, a predetermined proportion of the component monomer (a) and the component monomer (b) in the polar solvent, preferably an aqueous solvent, and the concentration of the total amount thereof is usually 20 to 80 wt. %, Preferably 25 to 75% by weight, and the above-mentioned radical initiator is preferably 0.1 to 15 mol%, more preferably 0.5 to 12 mol%, based on the total amount of monomers. In addition, the polymerization reaction is performed at a temperature of about 30 to 90 ° C, preferably 40 to 80 ° C. The reaction time depends on the type of monomer, the type of radical initiator, the reaction temperature, and the like, and cannot be determined in general, but usually about 24 to 120 hours is sufficient.
[0053]
Since the allylamine-allylsulfonic acid copolymer thus formed forms an addition salt and / or a quaternary ammonium salt, the addition salt and / or the quaternary ammonium salt is formed by a known method. It may be taken out in a form and purified, or if desired, after treatment with alkali, it may be taken out in a free form and purified. Furthermore, a desired acid can be added to the polymer in the free form purified in this way to form a complete addition salt or a partial addition salt.
[0054]
The allylamine-allylsulfonic acid copolymer thus obtained has the property of being dissolved in water in the range of pH 1 to 13 despite being an amphoteric polymer compound, and is used as a paper processing agent and dyeing assistant. It is useful as an agent. In particular, when used as a paper treating agent, excellent light resistance can be imparted.
[0055]
The present invention also includes the allylamine-allylsulfonic acid copolymer.For inkjet printerA paper treatment agent is also provided. This paper treatment agent is superior in light resistance compared to conventional paper treatment agents containing polyallylamine, such as paper used in inkjet printers, etc.ForI can.
[0056]
【Example】
EXAMPLES Next, although an Example demonstrates this invention further in detail, this invention is not limited at all by these examples.
[0057]
The polymerization average molecular weight of the copolymer was measured according to the following method.
<Measurement of weight average molecular weight of copolymer>
The weight average molecular weight (Mw) of the copolymer was measured by gel permeation chromatography (GPC method) using Hitachi L-6000 type high performance liquid chromatograph. The eluent flow path pump is Hitachi L-6000, the detector is Shodex RI SE-61 differential refractive index detector, the column is Asahi Pack's water-based gel filtration type GS-220HQ (exclusion limit molecular weight 3,000) and GS- 620HQ (exclusion limit
[0058]
Example 1
In a 3000 ml four-necked round bottom separable flask equipped with a stirrer, thermometer and reflux condenser, 360.3 g (2.5 mol) of sodium allyl sulfonate was charged and allylamine hydrochloride having a concentration of 57.3 wt% 408.3 g (2.5 mol) of an aqueous salt solution was added, and 419.8 g of distilled water was further added to prepare a uniform transparent monomer solution. With stirring at a temperature of 50 ° C., 2,2′-azobis (2-amidinopropane) dihydrochloride (ABAP) 27.1 g (2.0 mol% based on the monomer) was added, and the polymerization reaction was further carried out. ABAP 40.68 g (3.0 mol%) was also added 24 hours after the start. The polymerization reaction was carried out at 50 ° C. for a total of 72 hours.
[0059]
The obtained reaction solution was poured into methanol to form a white precipitate, which was further washed with methanol, filtered, and vacuum dried at 50 ° C. for 72 hours. 443.2 g (isolation yield 74.59%) of white fine powdery crude copolymer was obtained. The crude copolymer had a weight average molecular weight of 1500.
[0060]
In a 1000 ml four-necked round bottom separable flask equipped with a stirrer, thermometer, and reflux condenser, 163.8 g (0.72 mol) of the above crude polymer was charged, and 200 g of distilled water was added and dissolved. It was. 28.6 g of sodium hydroxide dissolved in 200 g of distilled water was gradually added dropwise. The resulting solution was demonomerized using an evaporator and then dialyzed. The desalted solution was concentrated, poured into methanol and purified by reprecipitation, washed, filtered, and dried under vacuum heating.
[0061]
An infrared spectrum of the obtained white fine powder copolymer (free) is shown in FIG. A chromatogram by GPC measurement is shown in FIG. The intrinsic viscosity measured in a 1/10 mol / liter NaCl aqueous solution at a concentration of 0.5 g / dl at 25 ° C. was 0.0244. As a result of elemental analysis, C = 36.33%, H = 7.34%, N = 5.92%, and S = 15.05%. From these results, the copolymerization ratio of sodium allylsulfonate: allylamine was 1: 0.75.
[0062]
Examples 2 to 12, Comparative Example 1
In Example 1, instead of allylamine hydrochloride, allylamine salts shown in Table 1 were used, and radical initiators shown in Table 1 were used for polymerization in the same manner as in Example 1 to obtain a crude copolymer. .
The polymerization yield and weight average molecular weight of this crude copolymer are shown in Table 1 together with the monomer concentration and the amount of radical initiator used.
[0063]
[Table 1]
[0064]
[note]
MMAA · HCl: N-methylallylamine hydrochloride
DMAA · HCl: N, N-dimethylallylamine hydrochloride
AA / NH2SOThreeH: Monoallylamine amide sulfate
DAA · HCl: diallylamine hydrochloride
MDAA · HCl: N-methyldiallylamine hydrochloride
HOEDAA · HCl: N-hydroxyethyldiallylamine hydrochloride
DADMAC: diallyldimethylammonium chloride
AA / HCl: Allylamine hydrochloride
ABAP: 2,2'-azobis (2-amidinopropane) dihydrochloride
VA-044: 2,2'-azobis [2- (2-imidazolin-2-yl) propane] dihydrochloride
VA-086: 2,2'-azobis [2-methyl-N- (2-hydroxyethyl) propionamide]
OTazo-30: 2,2'-azobis (2-methylbutanamidoxime) dihydrochloride
APS: ammonium persulfate
AIBN: Azobisisobutyronitrile
[0065]
In Comparative Example 1, water-insoluble azobisisobutyronitrile (AIBN) was used as a radical initiator, so that no polymerization reaction occurred.
In addition, in FIG. 3, the chromatogram by GPC measurement of the copolymer obtained in Example 5 is shown.
[0066]
Examples 13-18
Polymerization was carried out in the same manner as in Example 1 under the conditions of the monomer charge ratio, monomer concentration, and amount of radical initiator used shown in Table 2 to obtain a crude copolymer.
Table 2 shows the polymerization ratio and intrinsic viscosity of this crude copolymer. The intrinsic viscosity is a value measured at 25 ° C. and a concentration of 0.5 g / dl in a 1/10 mol / liter NaCl aqueous solution.
[0067]
[Table 2]
[0068]
Test example 1 Light resistance test
10 parts by weight of silica ["Fine Seal X-37B" manufactured by Tokuyama Co., Ltd.], 3 parts by weight of Poval ["PVA-117" manufactured by Kuraray Co., Ltd.] and 2 parts by weight of the polymer to be tested were mixed, and the silica concentration was 15 A paper treating agent was prepared by adjusting the weight percent.
Apply the above paper treatment agent to plain paper (copy paper) uniformly using “RDS Laboratory Coating Rod” manufactured by Sanya Kasei Co., Ltd. so that the dry thickness is 10 μm. A test paper was prepared by heating and drying.
[0069]
Next, after printing on this test paper using a commercially available inkjet printer “EPSON PM-770C”, using this “Xenon Fade Meter X25F” manufactured by Suga Test Instruments Co., Ltd., irradiance 60 W / m2, BPT (black panel temperature) 63 ° C., humidity 50% RH, irradiation time 22 hours, and the light resistance was evaluated according to the following criteria using visual and color difference meter “Minolta CR-321”. . The results are shown in Table 3.
A: No fading
B: Almost no fading
C: Some fading
D: Fading
[0070]
[Table 3]
[0071]
1) Blank: A paper treatment agent to which no polymer to be tested is added.
2) PAA: polyallylamine, manufactured by Nitto Boseki Co., Ltd.,
3) PEI: polyethyleneimine, manufactured by Nippon Shokubai Chemical Industry Co., Ltd., Mw1800
4) PVAm: polyvinylamine, manufactured by Mitsubishi Chemical Corporation, Mw 60000
[0072]
From Table 3, it can be seen that the allylamine-allylsulfonic acid copolymer of the present invention imparts good light resistance when used as a paper treating agent. In particular, free copolymers impart excellent light resistance.
[0073]
Test example 2 Water resistance test
A test paper was prepared by dissolving a polymer to be tested in distilled water, immersing plain paper in the polymer solution, and drying.
Next, this test paper was printed using various printers, and after natural drying, a drop of distilled water was dropped. After natural drying, the state of bleeding was visually evaluated.
[0074]
Each allylamine-allylsulfonic acid copolymer obtained in the Examples was improved in water resistance as in the case of polyallylamine as compared with the blank.
[0075]
【The invention's effect】
According to the present invention, an allylamine-allylsulfonic acid copolymer useful as a paper treating agent, particularly a paper treating agent excellent in light resistance, can be obtained with good yield and industrially advantageously by a simple operation.
[Brief description of the drawings]
1 is an infrared spectrum diagram of an electrodialysis-treated SAS / AA copolymer obtained in Example 1. FIG.
2 is a chromatogram obtained by GPC measurement of the electrodialyzed SAS / AA copolymer obtained in Example 1. FIG.
3 is a chromatogram of the SAS / DAA · HCl copolymer obtained in Example 5 by GPC measurement. FIG.
Claims (6)
で表される構成単位およびその付加塩の中から選ばれる少なくとも1種と、(B)一般式(III)
で表される構成単位を有し、共重合性架橋剤に由来する単位を含まないことを特徴とするアリルアミン−アリルスルホン酸系共重合体。(A) General formula (I), general formula (II-a) and general formula (II-b)
At least one selected from the structural units represented by formula (II) and an addition salt thereof, and (B) the general formula (III)
Allylsulfonic acid copolymer - allylamine which have a in structural units represented by and wherein the free of units derived from copolymerizable crosslinking agent.
で表されるアリルアミン類の付加塩から選ばれる少なくとも1種と、(b)一般式(VI)
で表されるアリルスルホン酸化合物を共重合させることを特徴とする請求項1または2に記載のアリルアミン−アリルスルホン酸系共重合体の製造方法。In a polar solvent, in the presence of a water-soluble radical initiator or a persulfate radical initiator having an azo group in the molecule, (a) general formula (IV) and general formula (V)
At least one selected addition salts or these allylamines represented in, (b) the general formula (VI)
The method for producing an allylamine-allylsulfonic acid copolymer according to claim 1, wherein an allylsulfonic acid compound represented by the formula:
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001098480A JP3674841B2 (en) | 2001-03-30 | 2001-03-30 | Allylamine-allylsulfonic acid copolymer, its production method and use |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001098480A JP3674841B2 (en) | 2001-03-30 | 2001-03-30 | Allylamine-allylsulfonic acid copolymer, its production method and use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2002293842A JP2002293842A (en) | 2002-10-09 |
| JP3674841B2 true JP3674841B2 (en) | 2005-07-27 |
Family
ID=18952127
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001098480A Expired - Lifetime JP3674841B2 (en) | 2001-03-30 | 2001-03-30 | Allylamine-allylsulfonic acid copolymer, its production method and use |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3674841B2 (en) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4144487B2 (en) * | 2003-09-12 | 2008-09-03 | セイコーエプソン株式会社 | Liquid composition |
| JP4576815B2 (en) * | 2003-09-12 | 2010-11-10 | 日東紡績株式会社 | Modified polyallylamine and method for producing the same |
| JP4332846B2 (en) * | 2003-10-07 | 2009-09-16 | セイコーエプソン株式会社 | Liquid composition |
| JP4581413B2 (en) * | 2004-01-29 | 2010-11-17 | 日東紡績株式会社 | Allylamine acid addition salt polymer, process for producing the same, and ink jet recording paper agent |
| JP5779016B2 (en) | 2010-07-30 | 2015-09-16 | 株式会社豊田中央研究所 | Electrolyte, fuel cell, Li secondary battery, secondary battery, and primary battery |
| JP7276669B2 (en) * | 2018-02-23 | 2023-05-18 | 日東紡績株式会社 | Allylamine-based copolymer and method for producing the same |
| CN108864363B (en) * | 2018-07-09 | 2020-12-11 | 中国海洋石油集团有限公司 | Amphoteric flocculant and preparation method and application thereof |
-
2001
- 2001-03-30 JP JP2001098480A patent/JP3674841B2/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP2002293842A (en) | 2002-10-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US5510004A (en) | Azetidinium polymers for improving wet strength of paper | |
| EP1022383B1 (en) | Sheet surface treating agent and ink-jet printing paper | |
| CN101622288A (en) | Cationic copolymer of derived from acrylamides and uses thereof | |
| US6395849B1 (en) | Processes for producing N,N-dialkylallylamine polymers and N,N-dialkyllylamine polymers | |
| JP3674841B2 (en) | Allylamine-allylsulfonic acid copolymer, its production method and use | |
| JP4714031B2 (en) | Diallylamine copolymer, process for producing the same, and hard surface treating agent | |
| JP3724576B2 (en) | Diallylamine-allylsulfonic acid-sulfur dioxide copolymer, its production method and use | |
| JP3852111B2 (en) | Allylamine-acrylamide-allylsulfonic acid copolymer, its production method and use | |
| PT1364804E (en) | Cationic coating for printable surfaces | |
| JP3547106B2 (en) | Fixing agent for inkjet printing paper and method of using the same | |
| JP4058126B2 (en) | Inkjet recording paper manufacturing method | |
| JP3595995B2 (en) | Inkjet recording medium | |
| JP5027354B2 (en) | Additives for recording media | |
| JP3671305B2 (en) | Coating liquid for ink jet recording medium and recording medium | |
| US7732527B2 (en) | Water-soluble polymers reduced in molecular weight, process for production thereof and usage thereof | |
| JP3846568B2 (en) | INK JET RECORDING MEDIUM, MANUFACTURING METHOD THEREOF, AND INK JET RECORDING PAPER | |
| JP2002079742A (en) | Sheet surface-treating agent and ink jet system recording medium | |
| JP2001039013A (en) | Method for preparing dispersion for coating | |
| EP1358069B1 (en) | Improved ink jet printing paper and methods for producing and using the same | |
| JP2004002692A (en) | Water-soluble polymer having lowered molecular weight, its preparation process, and method of using it | |
| JP3842388B2 (en) | Inkjet printing paper manufacturing method | |
| JP4581413B2 (en) | Allylamine acid addition salt polymer, process for producing the same, and ink jet recording paper agent | |
| JP4474696B2 (en) | Diallylalkylenediamine polymer and ink composition using the same | |
| JPH0839927A (en) | Surface coating agent of paper | |
| JP2000045196A (en) | Surface-coating agent for making paper, and surface- coated paper |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20040924 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20040929 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20041125 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20050408 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20050421 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 3674841 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090513 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090513 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100513 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110513 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110513 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120513 Year of fee payment: 7 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120513 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130513 Year of fee payment: 8 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130513 Year of fee payment: 8 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140513 Year of fee payment: 9 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |